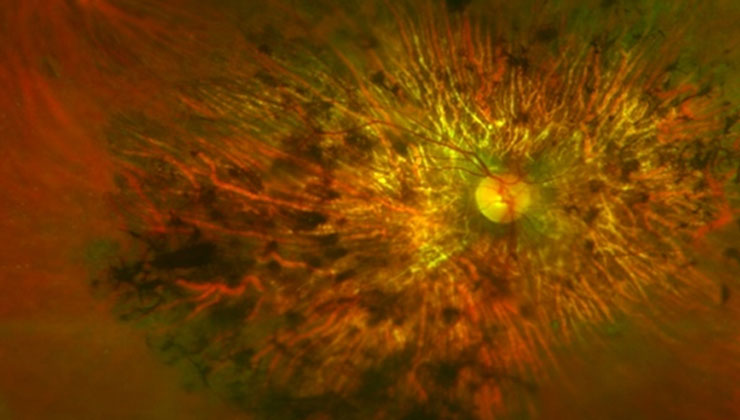
Las distrofias retinianas son un conjunto heterogéneo de enfermedades hereditarias que provocan una pérdida progresiva y severa de visión, dado que alteran la anatomía y/o la función de la retina. Actualmente no tienen cura, aunque se está investigando para poder tratarlas, en los próximos años, con terapias génicas y celulares.
Estas patologías pueden causar un daño en las células fotorreceptoras, bien sean, predominantemente, los conos (responsables de la visión en detalle y de color), los bastones (especializados en la visión nocturna y periférica) o ambos a la vez. Es el caso de la enfermedad de Stargardt, la retinosis pigmentaria o la distrofia de conos-bastones, respectivamente.
También hay ciertas distrofias hereditarias, como la retinosquisis juvenil, la vitreoretinopatía exudativa familiar o el síndrome de Stickler, en las que se producen alteraciones del vítreo y de la retina. En otras, como la coroideremia, el problema de base está en la coroides, capa situada por debajo de la retina.
La mayoría de distrofias de retina son enfermedades localizadas exclusivamente en el ojo, aunque a veces pueden asociarse a manifestaciones extraoculares (síndrome de Usher, síndrome de Bardet-Biedl) en cuyo caso hablamos de distrofias retinianas sindrómicas.
Por su baja prevalencia, las distrofias de la retina son consideradas enfermedades minoritarias o “raras” (afectan a menos de 1 de cada 2.000 personas).
Hay varios estudios en marcha para poder ofrecer tratamiento a las distrofias de la retina.
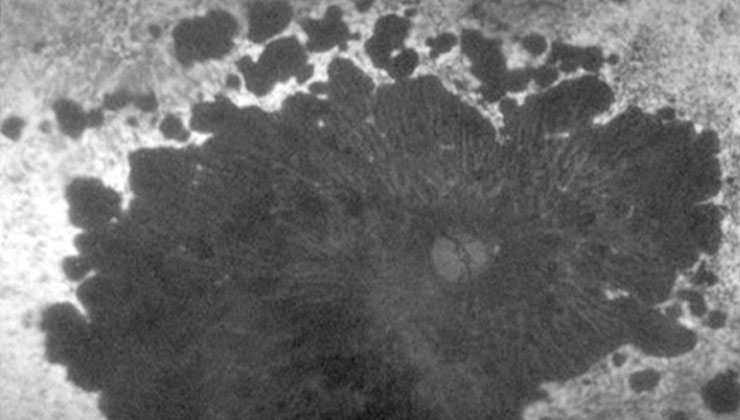
Esta imagen, igual que la superior, corresponde a una distrofia de conos-bastones, que afecta tanto a la visión central como periférica.
Las distrofias de la retina tienen origen genético, por lo que pueden transmitirse de generación en generación mediante diferentes tipos de herencia.
La retinosis pigmentaria, la distrofia de la retina más frecuente, es un ejemplo de patología que puede transmitirse a través de los tres patrones de herencia mencionados, en función del gen implicado.
La genética de las distrofias de retina es compleja: una misma patología puede estar causada por varios genes y, a la vez, un mismo gen puede estar relacionado con diferentes enfermedades. Actualmente, se han descrito más de 250 genes asociados a las distrofias retinianas, aunque se estima que todavía faltan muchos por identificar.
La información genética contenida en el ADN de cada persona es la que determina que se desarrolle una distrofia de la retina y, por tanto, estas patologías hereditarias no se pueden prevenir. Sin embargo, un aspecto en el que sí se puede incidir es en su detección precoz por parte de oftalmólogos especialistas, mediante una revisión ocular completa que incluya una buena anamnesis y una exploración exhaustiva del fondo de ojo, además de técnicas complementarias, como la OCT, la autofluorescencia o las pruebas electrofisiológicas.
A menudo, las distrofias retinianas no son evidentes hasta fases avanzadas, cuando sus síntomas se hacen patentes. Para poder anticiparse a la enfermedad y predecir su evolución, es de gran utilidad conocer la causa molecular que la desencadena en cada paciente a través del diagnóstico genético, que también permite confirmar el diagnóstico clínico, identificar el patrón de herencia y ofrecer consejo genético a la familia, indicando la probabilidad de transmitir la patología y alertando a los familiares portadores.
Asimismo, el diagnóstico genético abre la puerta a prevenir, detener o revertir en el futuro la pérdida de visión de los pacientes afectados, mediante el desarrollo de nuevas terapias individualizadas que están en investigación.
Los síntomas, así como la rapidez de su evolución, varían según el tipo de distrofia de retina y cada paciente. No obstante, los más comunes son:
Otras posibles señales pueden ser la percepción deformada de objetos (metamorfopsia) o la alteración en la percepción de los colores (discromatopsia).
Las distrofias de la retina actualmente no tienen cura, debido a la dificultad de regenerar las células retinianas afectadas. El futuro tratamiento de estas patologías pasa por el diseño y aplicación de nuevas terapias génicas y celulares que permitan devolver visión o frenar su pérdida.
Actualmente, se están dando pasos importantes en esta línea de investigación (desde 2018, se ha empezado a comercializar la primera terapia génica en Estados Unidos, diseñada para un gen responsable de amaurosis congénita de Leber) y el Departamento de Genética del Instituto también se orienta a ello con varios proyectos promovidos por Fundación IMO.
Para preparar a los candidatos a estas terapias génicas es fundamental disponer de un diagnóstico genético, que IMO ofrece de forma pionera.
En paralelo, el Instituto también apuesta por otra vía alternativa y complementaria de tratamiento: la visión artificial, a cuyo desarrollo contribuye participando en estudios con nuevos modelos de chip de retina. Es el caso del IRIS®II, que ha implantado en la primera paciente de Europa.